Estructura Atómica
Las hipótesis de Dalton sobre la existencia de los átomos como la parte más pequeña de la materia dejaron una puerta abierta a los científicos de la época. Desde los tiempos de la antigua Grecia se conocía la propiedad de algunas sustancias de atraer objetos ligeros al frotarse con las pieles de algunos animales. Esta fuerza de atracción se atribuyó a la carga eléctrica adquirida por el cuerpo frotado. Mucho tiempo después con el descubrimiento de la electricidad se confirmó la teoría de los griegos: Las cargas eléctricas existían y podían ser de dos tipos: Positivas y Negativas.
De esta manera se llegó a la conclusión de que la materia es neutra, ya que posee el mismo número de cargas positivas y negativas, lo que neutraliza sus efectos. Al frotar una sustancia con otra es posible que las cargas de un signo determinado pasen de una sustancia a otra. El cuerpo adquiere una carga igual a la carga perdida, pero de signo contrario, o una carga idéntica a las cargas recibidas.
Partículas subatómicas
Si la materia es susceptible de cargarse eléctricamente y está formada por átomos, éstos no pueden ser tan indivisibles como pronosticaba Dalton, ya que la existencia de dos tipos de cargas demuestra que en su interior existen al menos dos tipos de partículas, unas con carga positiva y otras negativas. De este modo y mediante el trabajo de investigación de varios científicos de describieron las partículas fundamentales.

Electrón
Fue descrito como partícula fundamental de carga negativa por el físico británico Sir Joseph John Thomson en 1897 gracias a sus experimentos con un tubo de rayos catódicos.
Protón
Doce años después del descubrimiento de los electrones, en el físico británico Ernest Rutherford, mientras realizaba las primeras transmutaciones atómicas artificiales, encontró la partícula fundamental de carga positiva, el protón.
Neutrón
La existencia de los electrones y protones no explicaba de manera satisfactoria la masa de los elementos, y se vio la necesidad de una tercera partícula neutra, que denominaron neutrón. Pero no fue hasta 1932 que el físico británico sir James Chadwick lo descubrió cuando estudiaba las emisiones del berilio radioactivo.
En la actualidad se ha demostrado que estas partículas fundamentales, pueden a su vez descomponerse en otras que se clasifican en quarks y leptones.
- Quarks: Poseen cargas eléctricas positivas o negativas fraccionarias y además otro tipo de cargas no eléctricas, llamadas de color, que pueden ser azules, verdes o rojas (se llaman así porque las tres juntas se neutralizan). Existen seis tipos de quarks: up, down, charm, strange, top, y bottom. De cada tipo de quark existen tres variedades.
- Leptones: Son leptones: el electrón, el neutrino electrónico, el muón, el neutrino muónico, el tauón, y el neutrino tauónico. No tienen cargas de color y, cuando tienen carga eléctrica, como el electrón, el muón o el tauón, ésta es negativa e igual a menos uno.
Propiedades
Como ya se sabe, de acuerdo con el modelo atómico actual, el átomo está constituido en su núcleo por neutrones y protones, mientras que los electrones se encuentran en constante movimiento alrededor del núcleo, en zonas llamadas orbitales.
Número atómico
Los átomos de diferentes elementos presentan diferentes números de protones. El número atómico (Z) indica la cantidad de protones presentes en el núcleo de un átomo. Este define la configuración electrónica del átomo y permite el ordenamiento de los distintos elementos químicos en la tabla periódica. Ejem: hidrógeno (H) su Z=1.
Datos Importantes
Indica el número de protones en el núcleo atómico.El elemento y su lugar en la tabla periódica deriva de su número atómico.En un átomo eléctricamente neutro, el número atómico será igual al número de electrones del átomo que se encuentran en los orbitales. Hay que recordar que los electrones determinan el comportamiento químico del átomo.Hay que recordar que los átomos que tienen carga eléctrica se llaman iones. Estos pueden tener una cantidad mayor de electrones (carga positiva o cationes) o menor (carga negativa o aniones) que el número atómico.

Masa atómica
Se define como la totalidad de la masa de protones y neutrones pertenecientes a un único átomo en reposo. También suele ser definida como peso atómico, no obstante, esto no es del todo una aseveración correcta debido a que la masa constituye una propiedad del cuerpo y el peso fluctúa según la gravedad a la que se vea expuesto dicho cuerpo.
Tabla periódica
Hacia el año 1830, se conocían 55 elementos diferentes, es decir, muchos si se comparan con los cuatro elementos reconocidos por los antiguos. Estos elementos variaban enormemente en sus propiedades, y parecería existir poco orden entre ellos. Sin embargo, había que buscar un orden en el conjunto de los elementos conocidos, y quizá de esta manera se podría encontrar alguna razón que permitiera explicar el número de elementos posibles y justificar la variación de sus propiedades.
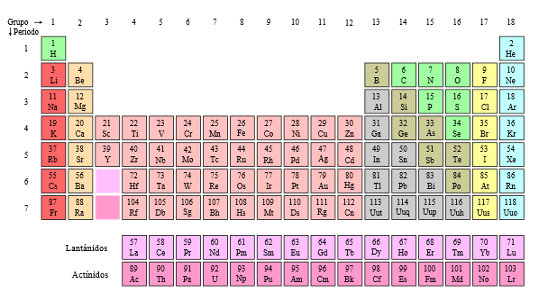
Tabla periódica actual
Consta de dieciocho columnas que constituyen dieciséis grupos. Los grupos están divididos en dos subgrupos, A y B. Los ocho grupos A contienen a los elementos llamados normales o representativos, y se encuentran situados en los extremos de la tabla. Los grupos B ocupan la parte central de la tabla y están formados por los metales de transición. El grupo VIII B lo forman tres columnas.
La tabla consta en su parte principal de siete hileras de elementos correspondientes a siete periodos. Hay dos hileras, generalmente colocadas fuera de la tabla principal, que son los lantánidos y los actínidos, que en realidad pertenecen a los periodos sexto y séptimo, respectivamente. La longitud de los periodos va desde los dos elementos del primero hasta los 32 del sexto.
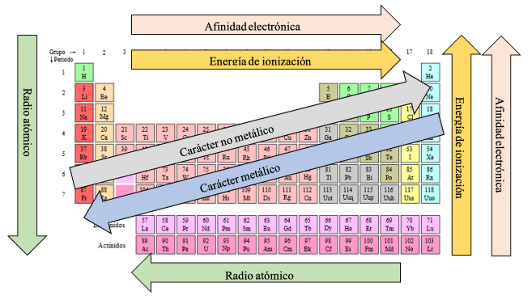
Propiedades periódicas
Se trata de una serie de propiedades que varían de forma uniforme a lo largo de la tabla periódica.
- Energía de ionización: Es la energía necesaria para arrancar un electrón de un elemento.
La energía de ionización aumenta de la izquierda a la derecha y de abajo a arriba.
- Afinidad electrónica: Es la energía que se libera cuando un átomo adquiere un electrón.
Varía prácticamente igual que la energía de ionización. El elemento más electroafin sería el flúor, y el menos sería el francio.
- Electronegatividad: Es la fuerza con la que un átomo atrae a los pares de electrones compartidos, y varia de la misma forma que las anteriores. El carácter electronegativo es el que divide a los elementos en metales (poco electronegativos) y no metales (muy electronegativos).
- Radio atómico: Se considera que el radio atómico es la mitad de la distancia que separa dos núcleos de un mismo elemento unidos entre sí. Como esta distancia varía ante la presencia de otros elementos distintos se ha tomado como radio atómico la media de la distancia medida en un gran número de compuestos. A lo largo de un grupo, el radio atómico aumenta con la masa atómica, ya que al pasar de un periodo a otro aumenta el número del nivel del electrón más externo. A lo largo de un periodo, en principio el radio disminuye con el número atómico, ya que los electrones diferenciales pertenecen al mismo nivel, pero el núcleo va aumentando su carga positiva al pasar de un elemento de numero atómico Z a otro de número atómico Z + 1.
- Carácter metálico: Existen muchas propiedades periódicas que en general están relacionadas con las anteriores. Una de ellas es el carácter metálico que varía exactamente igual que la electronegatividad, de tal forma que, un elemento electronegativo es un no metal y un elemento muy poco electronegativo, un metal.
- Estado de agregación: La materia de acuerdo con sus propiedades físicas se clasifica en tres estados de agregación; solido, líquido y gas. Se han agregado dos nuevos que son el plasma y el condensado de Bose-Einstein.
- Solido: Ocupa un volumen fijo y tiene una forma definida. Sus partículas tienen una movilidad prácticamente nula y la fuerza de cohesión entre ellas es muy alta.
- Liquido: No posee una forma física propia, sino que se adata a la del recipiente que lo contiene. La movilidad y cohesión de sus partículas es intermedia.
- Gas: No posee ni volumen ni forma definida, tiende a ocupar el volumen del recipiente en el que se contiene. Sus partículas tienen una gran energía cinética, presentan movimientos desordenados y fuerza de cohesión muy baja.
- Plasma: En términos simples se considera como plasma a un gas que se ha calentado a una temperatura tan elevada que sus átomos y moléculas se convierten en iones. La concentración de aniones y cationes es casi idéntica, por tanto, es eléctricamente neutro y buen conductor de la corriente eléctrica.
- Condensado de Bose-Einstein: Se define de forma muy simplificada como un gas que se ha enfriado a una temperatura próxima al cero absoluto. Los átomos pierden energía, se frenan y se unen para dar origen a un superátomo insólito.
Diagrama que resumen las propiedades periódicas
Propiedades físicas y químicas de metales, no metales, semimetales y gases nobles
| Propiedades físicas | Propiedades químicas | |
| Metales | Conductividad eléctrica elevada que disminuye al aumentar la temperatura. Conductividad térmica elevada. Brillo metálico. Son sólidos a temperatura ambiente excepto el mercurio. Son dúctiles. Maleables Forman enlaces metálicos. | Tienen pocos electrones de valencia. Su afinidad electrónica es débil, tiende a aceptar electrones. Energía de ionización baja, forman cationes con facilidad. Electronegatividad baja. Forman compuestos iónicos con los no metales. |
| No metales | Conductividad eléctrica generalmente deficiente. Conductividad térmica generalmente deficiente. Sin brillo metálico. Su estado de agregación varía entre sólidos, líquidos y gas. No son dúctiles. En estado sólido son quebradizos. Suelen formar enlaces covalentes. | Tienen a tener muchos electrones de valencia. Su afinidad electrónica es elevada, tienden a aceptar electrones formando aniones con facilidad. Su energía de ionización es elevada. Electronegatividad elevada. Forman compuestos iónicos con los metales. |
| Semimetales | Poseen propiedades físicas semejantes a las de los metales y no metales. Son sólidos a temperatura ambiente. La mayoría presentan brillo metálico. Generalmente son muy duros. Se pueden presentar en diferentes formas alotrópicas. Son semiconductores (no son buenos conduciendo electricidad ni calor). | Tienen tres o más electrones en su capa de valencia. Su reactividad es variada. Dada su reactividad se encuentran en varios compuestos de uso variado. Ejem: el boro reacciona con el hidrógeno formando hidruros que se usan en laboratorios. |
| Gases nobles | Por definición su estado de agregación es el gaseoso. Sus uniones son por fuerzas intermoleculares muy débiles. Las propiedades físicas macroscópicas de los gases nobles están determinadas por las fuerzas d Van der Waals. Puntos de fusión y ebullición muy bajos. Todos son gases monoatómicos bajo condiciones estándar. El helio tiene varias propiedades únicas con respecto a otros elementos: tanto su punto de ebullición como el de fusión son menores que los de cualquier otra sustancia conocida; es el único elemento conocido que presenta superfluidez. | Son incoloros, inodoros, insípidos y no inflamables en condiciones normales. Tienen sus capas de valencia llenas porque son extremadamente estables y por ende no tienden a formar enlaces químicos. Su reactividad es extremadamente baja pero no es nula. |
