Enlaces químicos y su relación con la electronegatividad
La química es una ciencia que se enfoca en el estudio de la materia, sus propiedades, transformaciones y la energía implicada en estos procesos. Una parte fundamental de la química es entender cómo los átomos se unen para formar compuestos, y aquí es donde entran en juego los enlaces químicos.
Un enlace químico representa la fuerza de atracción que mantiene unidos a los átomos dentro de una molécula o un compuesto. Existen principalmente tres tipos de enlaces químicos: iónicos, covalentes y metálicos, cada uno con características y propiedades distintas. El entendimiento de estos enlaces es crucial, ya que determinan la estructura y propiedades de todas las sustancias químicas.
Los enlaces químicos son esenciales para la formación de compuestos y moléculas, y juegan un papel crucial en la diversidad de la materia que observamos en la naturaleza y en los materiales que utilizamos diariamente. Por ejemplo, la fortaleza y la rigidez del diamante se deben a los fuertes enlaces covalentes entre los átomos de carbono, mientras que la conductividad eléctrica de los metales se debe a sus enlaces metálicos.
Niveles de energía y grupos
La expresión que indica la distribución de los electrones en los distintos orbitales se denomina configuración electrónica de los átomos. En general se escribe la configuración de los átomos en estado fundamental o no excitado. Esto significa que los electrones se encuentran en su estado de energía más bajo posible.
Los electrones de un elemento poseen el nivel más bajo de energía posible, en estado no excitado. La energía de un electrón depende del nivel (n) y del subnivel (l) al que pertenecen. La energía de un electrón del nivel 1 es inferior a la de uno de nivel 2, y este a su vez es inferior a uno de nivel 3. Dentro de un mismo nivel, las energías están en orden creciente según los subniveles s, p, d, y f. En los niveles superiores la energía de un subnivel s o p del nivel siguiente, e incluso mayor que la del subnivel s del segundo. Existen reglas para memorizar el orden de las energías de los subniveles, como el diagrama de T. Moeller.
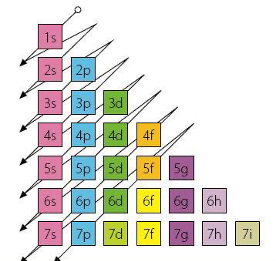
Los subniveles s pueden tener como máximo dos electrones, los subniveles p seis, los d diez, y los f catorce.
Los elementos de un mismo grupo poseen el mismo número de electrones en los niveles de mayor energía. Por ejemplo, los elementos del grupo IA poseen un electrón en el subnivel ns, donde n es el número cuántico principal, que coincide con el número del periodo, y se expresa ns1. Ejem: Na (Z=11):1s22s22p63s1
En los metales de transición el electrón de mayor energía es el d, y en los grupos II, IV… hasta el 0 o VIIIA, los electrones de mayor energía son p. Finalmente en los metales lantánidos y actínidos, llamados de doble transición, estos electrones son f.
Regla del octete
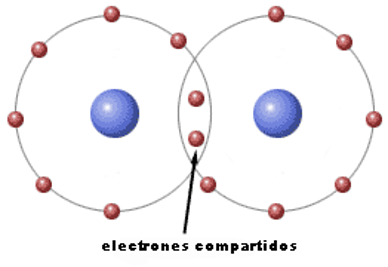
La regla del octete, que se debe al químico estadounidense Gilbert Newton Lewis, sostiene que el compartimiento de electrones entre dos átomos se produce hasta que todos los átomos enlazados posean la estructura electrónica de gas noble. Para llegar a esta condición, todos deben poseer ocho electrones en su nivel más externo sumados los propios y los compartidos.
Estructuras de Lewis

Pare el estudio de los enlaces, Lewis representaba los átomos por su símbolo y los electrones de su último nivel por puntos que situaba alrededor del símbolo. Si los electrones están apareados, pueden representarse por un segmento pegado al símbolo, y si el par de electrones interviene en el enlace, el segmento se representa perpendicular al símbolo uniendo los átomos que lo comparten.
Tipos de enlaces químicos (ejemplos y diferencia numérica de electronegatividad)
Se llama enlace a la fuerza que une a los átomos de una molécula entre sí o las fuerzas que mantienen unidas a una molécula con otra. Existen varios modelos de enlace, que intentan explicar las propiedades químicas de las sustancias. El modelo más intuitivo, y por lo tanto de más fácil comprensión, es el de los electrones de valencia, es decir, que sólo tiene en cuenta los electrones del nivel más externo.
En términos simples podemos clasificar a los enlaces como fuerzas intramoleculares (mantienen unidos los átomos de una molécula) y fuerzas intermoleculares (mantienen unidas una molécula con otra). Los enlaces intramoleculares son de mayor fuerza y se clasifican en tres tipos: metálicos, iónicos y covalentes.
Enlace Iónico
Es aquel tipo de enlace que se forma de la unión de un metal con un no metal. El enlace se realiza mediante un intercambio de electrones, quedando los dos elementos con el mismo número de electrones que el gas noble más cercano en la tabla (ley del octeto). Por ejemplo, el sodio posee 11 electrones: dos en el primer nivel, ocho en el segundo y uno en el tercero, es un metal con una pequeña energía de ionización; y el flúor es un no metal que posee nueve electrones: dos en el primer nivel y siete en el segundo. Según este modelo, el sodio cede un electrón al flúor, quedando ambos unidos por fuerzas electrostáticas.
En el caso de que los electrones cedidos no sean exactamente los que necesita el no metal, los átomos de uno y otro se combinan en una proporción determinada para que el balance de electrones sea nulo: CaCa2+ + 2e–, 2Cl + 2e– 2Cl–, con el intercambio de dos electrones, el ion calcio así formado junto con los dos iones de cloro darán el cloruro de calcio, CaCl2.
La solubilidad de los compuestos iónicos varía; son generalmente solubles en agua debido a la capacidad del solvente para estabilizar los iones, pero no se disuelven en solventes no polares como el hexano. Los puntos de fusión y ebullición de las sustancias iónicas son típicamente elevados, reflejando la intensa fuerza de atracción electrostática entre los iones de cargas opuestas. Estas sustancias no conducen electricidad en estado sólido ya que los iones están fijos en una estructura reticular, pero en estado líquido o disueltos en agua, los iones se mueven libremente y pueden transportar corriente.
Enlace Covalente
Es aquel enlace que se forma entre dos no metales. El modelo propuesto para este tipo de enlace fue sugerido por Lewis, y se basa en la compartición de electrones. Lewis representaba los electrones del último nivel como puntos situados alrededor del símbolo del elemento, situando los electrones compartidos entre los símbolos de los átomos unidos. Los electrones compartidos serán los necesarios para que ambos elementos posean, sumando los propios y los compartidos, ocho electrones. El enlace covalente puede ser simple si comparten un par de electrones, doble si comparten dos pares, y triple si hay tres pares compartidos.
A su vez también los enlaces covalentes se pueden clasificar en polares, no polares y dativos o coordinados.
- Polares: Existe una diferencia >0 y <1.7 en la electronegatividad entre los elementos que lo forman. Son dos no metales diferentes. Por ejemplo, H2O.
- No polares: La diferencia de electronegatividad entre los elementos que lo forman es de 0. Se forma por dos no metales iguales regularmente. Por ejemplo, Cl2, O2.
- Dativos o coordinados: Los electrones compartidos provienen del mismo átomo. Por ejemplo, cuando se unen in protón y una molécula de amoníaco para forma un ion amonio.
Los compuestos covalentes pueden ser polares o no polares, lo que influye en su solubilidad. Las moléculas polares son generalmente solubles en solventes polares como el agua, mientras que las moléculas no polares se disuelven en solventes no polares. Los puntos de fusión y ebullición pueden variar ampliamente: las moléculas pequeñas con enlaces covalentes no polares tienden a tener puntos de fusión y ebullición bajos, mientras que los compuestos con enlaces covalentes polares pueden exhibir puntos de fusión y ebullición más altos debido a las interacciones intermoleculares, como los puentes de hidrógeno. La conductividad eléctrica es generalmente baja, debido a la ausencia de electrones libres o iones móviles, aunque ciertas estructuras de enlaces covalentes (como las redes en diamantes o grafeno) pueden permitir la movilidad de electrones bajo ciertas condiciones.
Enlace Metálico
Son aquellos que se forman de la unión de un metal con otro metal. Para explicar las propiedades de conductividad del calor y la electricidad, así como las propiedades mecánicas de los metales, se propuso un modelo de enlace formado por los iones positivos rodeados de una nube de electrones procedentes de los niveles más externos de los átomos. Estos electrones no pertenecen a ningún átomo en particular, son atraídos por todos. Dichos electrones son los responsables de la conductividad eléctrica, ya que pueden desplazarse, y de la conductividad calorífica, ya que pueden vibrar. Si un metal se deforma, no varía la situación y por lo tanto no se rompe.
El enlace metálico se caracteriza por la existencia de una “nube electrónica” móvil. Esta nube está compuesta por electrones de valencia que no están fijos a un átomo en particular, sino que se mueven libremente alrededor de un enjambre estructurado de iones metálicos positivos. Esta libertad de movimiento de los electrones les permite conducir calor y electricidad con eficacia, proporcionando a los metales sus propiedades conductoras distintivas. Además, la naturaleza deslocalizada de los electrones permite que los metales se dejen moldear y doblar sin romperse, lo que se traduce en su maleabilidad y ductilidad.
En términos de solubilidad, los metales puros no se disuelven en solventes comunes debido a la fortaleza de los enlaces metálicos, pero pueden reaccionar químicamente para formar compuestos solubles. Su punto de fusión es generalmente alto, lo que refleja la fuerte atracción entre los iones y la nube electrónica, aunque existen excepciones como el galio o el mercurio. Su punto de ebullición también es alto debido a la considerable energía necesaria para separar los átomos en un estado gaseoso.
| Tipo de enlace | Definición | Características principales | Condiciones para su formación | Diferencia de Electrone -gatividad | Ejemplos |
| Iónico | Se forma cuando uno o más electrones se transfieren de un átomo a otro, resultando en la atracción entre iones. | Formación de estructuras cristalinas, altos puntos de fusión y ebullición, conductividad eléctrica en estado fundido o disolución. | Generalmente entre metales y no metales con una diferencia de electronegatividad mayor a 1.7. | > 1.7 | NaCl, CaSO4, KF, MgO |
| Covalente | Se establece cuando dos átomos comparten uno o más pares de electrones. | Bajos puntos de fusión y ebullición comparados con los iónicos, no conductores de electricidad. | Entre átomos con electronegatividades similares, típicamente no metales. | < 1.7 | H2O, CO2, CH4, C2H6 |
| Subtipos: | Polar: Electrones compartidos atraídos desigualmente. No polar: Electrones compartidos equitativamente. | Polar: 0 – 1.7, No polar: 0 | Polar: H2O, HF, No polar: O2, N2 | ||
| Metálico | Se da entre átomos de metales, donde los electrones de valencia se deslocalizan entre un entramado de iones. | Alta conductividad eléctrica y térmica, maleabilidad, ductilidad, y brillo. | Entre átomos de elementos metálicos. | No aplicable | Cu, Fe, Al, Na |
Preguntas EXANI-II
Pregunta 1 (Ejercicio tomado del Simulador EXANI-II):
Identifique el compuesto que presenta un enlace iónico.
- O2
- NaCl
- CO
Explicación:
Respuesta correcta b) NaCl.
El compuesto NaCl, o cloruro de sodio, exhibe un enlace iónico característico debido a la significativa diferencia de electronegatividad entre el sodio (Na) y el cloro (Cl), que es aproximadamente de 2.1. Esta gran diferencia facilita la transferencia completa de electrones del metal (Na) al no metal (Cl), resultando en la formación de iones Na+ y Cl− que se atraen electrostáticamente.
Las otras opciones no son respuestas correctas por las siguientes razones:
- a) O2 es incorrecto porque está formado por dos átomos del mismo elemento, oxígeno, que comparten electrones de manera equitativa, lo que resulta en un enlace covalente no polar. No hay diferencia de electronegatividad entre los mismos átomos.
- c) CO es incorrecto ya que es una molécula con un enlace covalente polar entre carbono (C) y oxígeno (O). Aunque hay una diferencia de electronegatividad entre C y O, los electrones son compartidos y no hay una transferencia completa como en los enlaces iónicos.
Pregunta 2 (Ejercicio tomado del Simulador EXANI-II):
Si la diferencia de electronegatividad entre el Ca y O es de 2.5, ¿qué tipo de enlace los une para formar un compuesto?
- Covalente
- Iónico
- Metálico
Explicación:
Respuesta correcta b) Iónico.
El enlace entre el calcio (Ca) y el oxígeno (O) es iónico debido a la diferencia de electronegatividad de 2.5, que supera el umbral generalmente aceptado de 1.7 para la formación de enlaces iónicos. En este caso, el Ca, con una electronegatividad de aproximadamente 1.0, cede electrones al O, que tiene una electronegatividad de alrededor de 3.5, formando iones Ca2+ y O2− que se unen electrostáticamente.
Las otras opciones no son respuestas correctas por las siguientes razones:
- a) Covalente es incorrecto porque aunque el oxígeno y el calcio podrían compartir electrones, la gran diferencia de electronegatividad favorece la transferencia completa de electrones y la formación de un enlace iónico.
- c) Metálico es incorrecto ya que los enlaces metálicos se forman entre átomos de metales, y el oxígeno no es un metal.
